- Исследование CDC по мониторингу безопасности дополнительной дозы вакцины COVID-19
- Что уже известно о thе бустерный выстрел?
- Среди 306 участников клинических испытаний Pfizer-BioNTech побочные реакции после дозы 3 были аналогичны побочным реакциям после дозы 2.
Что добавлено в этом отчете на кадре номер 3, выпущенном CDC сегодня?
В период с 12 августа по 19 сентября 2021 г. среди 12,591 3 зарегистрировавшегося v-safe, прошедшего медицинское обследование после всех трех доз мРНК вакцины COVID-19, 79.4% и 74.1% сообщили о местных или системных реакциях, соответственно, после третья доза; 77.6% и 76.5% сообщили о местных или системных реакциях после второй дозы соответственно.
Каковы последствия для практики общественного здравоохранения?
В добровольных отчетах в v-safe не было обнаружено никаких неожиданных паттернов побочных реакций после введения дополнительной дозы вакцины COVID-19. CDC продолжит мониторинг безопасности вакцин, в том числе для дополнительных доз COVID-19.
12 августа 2021 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) внесло поправки в разрешения на экстренное использование (EUA) вакцин Pfizer-BioNTech и Moderna COVID-19, чтобы разрешить введение дополнительной дозы после завершения серии первичной вакцинации лицам, имеющим право на вакцинацию. от умеренных до тяжелых иммунодефицитных состояний (1,2). 22 сентября 2021 года FDA санкционировало дополнительную дозу вакцины Pfizer-BioNTech через ≥6 месяцев после завершения первичной серии среди лиц в возрасте ≥65 лет, подверженных высокому риску тяжелой формы COVID-19 или чье профессиональное или институциональное воздействие подвергает их опасности. высокий риск COVID-19 (1). Результаты клинического исследования фазы 3, проведенного Pfizer-BioNTech с участием 306 человек в возрасте 18–55 лет, показали, что побочные реакции после получения третьей дозы, введенной через 5–8 месяцев после завершения серии двухдозовой первичной вакцинации мРНК, были аналогичны те, о которых сообщалось после приема дозы 2; эти побочные реакции включали от легкой до умеренной в месте инъекции и системные реакции (3). CDC разработал v-safe, добровольную систему наблюдения за безопасностью на базе смартфонов, чтобы предоставлять информацию о побочных реакциях после вакцинации против COVID-19.
Одновременно с авторизацией дополнительной дозы для лиц с иммунодефицитными состояниями платформа v-safe была обновлена, чтобы позволить зарегистрированным лицам вводить информацию о полученных дополнительных дозах вакцины COVID-19. В период с 12 августа по 19 сентября 2021 г. 22,191 19 зарегистрировавшийся v-safe сообщил о получении дополнительной дозы вакцины COVID-97.6. Большинство (2%) сообщили о серии первичных двухдозовых вакцинаций мРНК, за которыми следовала третья доза той же вакцины. Среди тех, кто прошел медицинский осмотр для всех 3 доз (12,591 58.1; 79.4%), 74.1% и 3% сообщили о местных или системных реакциях, соответственно, после дозы 77.6, по сравнению с 76.5% и 2%, которые сообщили о местных или системных реакциях. реакции, соответственно, после дозы 19. Эти первоначальные результаты указывают на отсутствие неожиданных побочных реакций после введения дополнительной дозы вакцины COVID-19; большинство этих побочных реакций были легкими или умеренными. CDC продолжит мониторинг безопасности вакцины, включая безопасность дополнительных доз вакцины COVID-XNUMX, и предоставит данные для руководства рекомендациями по вакцинам и защиты здоровья населения.
V-safe - это добровольная система наблюдения за безопасностью в США на базе смартфонов; вакцинированные лица, имеющие право на получение разрешенного или лицензированного вакцинного препарата, могут зарегистрироваться в системе v-safe. Платформа v-safe позволяет существующим зарегистрированным лицам сообщать о получении дополнительной дозы вакцины COVID-19, а новым зарегистрированным лицам вводить информацию обо всех полученных дозах вакцины COVID-19. Обзоры V-safe здоровья отправляются в дни 0–7 после каждой дозы вакцины и включают вопросы о месте инъекции, системных реакциях и воздействии на здоровье. * Опросы отправляются для получения последней введенной дозы.† Сотрудники Системы сообщений о побочных эффектах вакцин (VAERS) связываются с зарегистрированными лицами, которые указывают, что после вакцинации обращались за медицинской помощью, и поощряют или способствуют заполнению отчета VAERS, если это указано.§
Среди зарегистрированных лиц v-safe, которые сообщили о получении дополнительной дозы вакцины от COVID-19 в период с 12 августа по 19 сентября 2021 г., демографические данные, местные и системные реакции и последствия для здоровья, зарегистрированные в течение 0-7 дней, были описаны схемой вакцинации (т. Е. , производитель вакцины, полученной для каждой дозы). Лица, которые сообщили, что получали первичную серию вакцины от разных производителей или производителя, который был неизвестен или недоступен в США, или 2 дозы вакцины после получения однократной вакцины Janssen (Johnson & Johnson) (150), были исключены из анализа. побочных реакций после приема дополнительной дозы.
Время, прошедшее от завершения серии первичной вакцинации до получения дополнительной дозы, описывалось схемой вакцинации. Профили нежелательных явлений после доз 2 и 3 сравнивали для зарегистрированных лиц, получивших мРНК-вакцину от одного и того же производителя для всех 3 доз.¶ Программное обеспечение SAS (версия 9.4; SAS Institute) использовалось для проведения всех анализов. Эти действия по надзору были рассмотрены CDC и проведены в соответствии с действующим федеральным законодательством и политикой CDC. **
В период с 12 августа по 19 сентября 2021 г. в общей сложности 22,191 19 зарегистрировавшийся v-safe сообщил о получении дополнительной дозы вакцины COVID-XNUMX после завершения первичной серии (Таблица 1). Среди них 14,048 63.3 (30%) составляли женщины, и примерно по 18% каждый был в возрасте 49–50, 64–65 и 74–XNUMX лет.
Большинство зарегистрировавшихся (21,662 97.6; 98.6%) сообщили, что они получили третью дозу от того же производителя, что и их серия первичных мРНК-вакцин, включая 98.2% реципиентов Moderna и 341% реципиентов Pfizer-BioNTech. Немногие зарегистрированные лица (1.5; 10%) сообщили о серии первичной мРНК-вакцины с последующей дополнительной дозой мРНК-вакцины от другого производителя, дозой вакцины Янссена после получения серии первичной вакцинации мРНК (0.05; 19%) или дополнительной дозой вакцины. доза вакцины COVID-178 от любого производителя после вакцины Janssen (0.8; XNUMX%).
Среди 22,191 19 зарегистрировавшегося v-safe средний интервал от завершения серии первичной вакцинации против COVID-182 до получения дополнительной дозы составил 160 дня (межквартильный интервал [IQR] = 202–XNUMX дня) (Таблица 2). Среди тех, кто получил 2 дозы вакцины Янссена, средний интервал между дозами был короче (84 дня; IQR = 16–136 дней).
Часто сообщалось о местных (16,615 74.9; 15,503%) и системных (69.9 19; 15,761%) реакциях в течение недели после введения дополнительной дозы вакцины COVID-71.0, чаще всего на следующий день после вакцинации. Наиболее частыми реакциями были боль в месте инъекции (12,429 56.0; 9,636%), усталость (43.4 XNUMX; XNUMX%) и головная боль (XNUMX; XNUMX%).
Из 22,191 7,067 получателя дополнительной дозы в общей сложности 31.8 (28.3%) сообщили о воздействии на здоровье, и примерно 6,287% (401 1.8) сообщили, что они не могли выполнять обычные повседневные действия, чаще всего на следующий день после вакцинации. За медицинской помощью обратился 0.1 (XNUMX%) зарегистрировавшийся, и XNUMX (XNUMX%) были госпитализированы. Причины получения медицинской помощи или госпитализации не были определены в исследовании v-safe; однако с зарегистрированными лицами, которые указали, что после вакцинации обращались за медицинской помощью, связываются сотрудники VAERS и призывают их заполнить отчет VAERS.
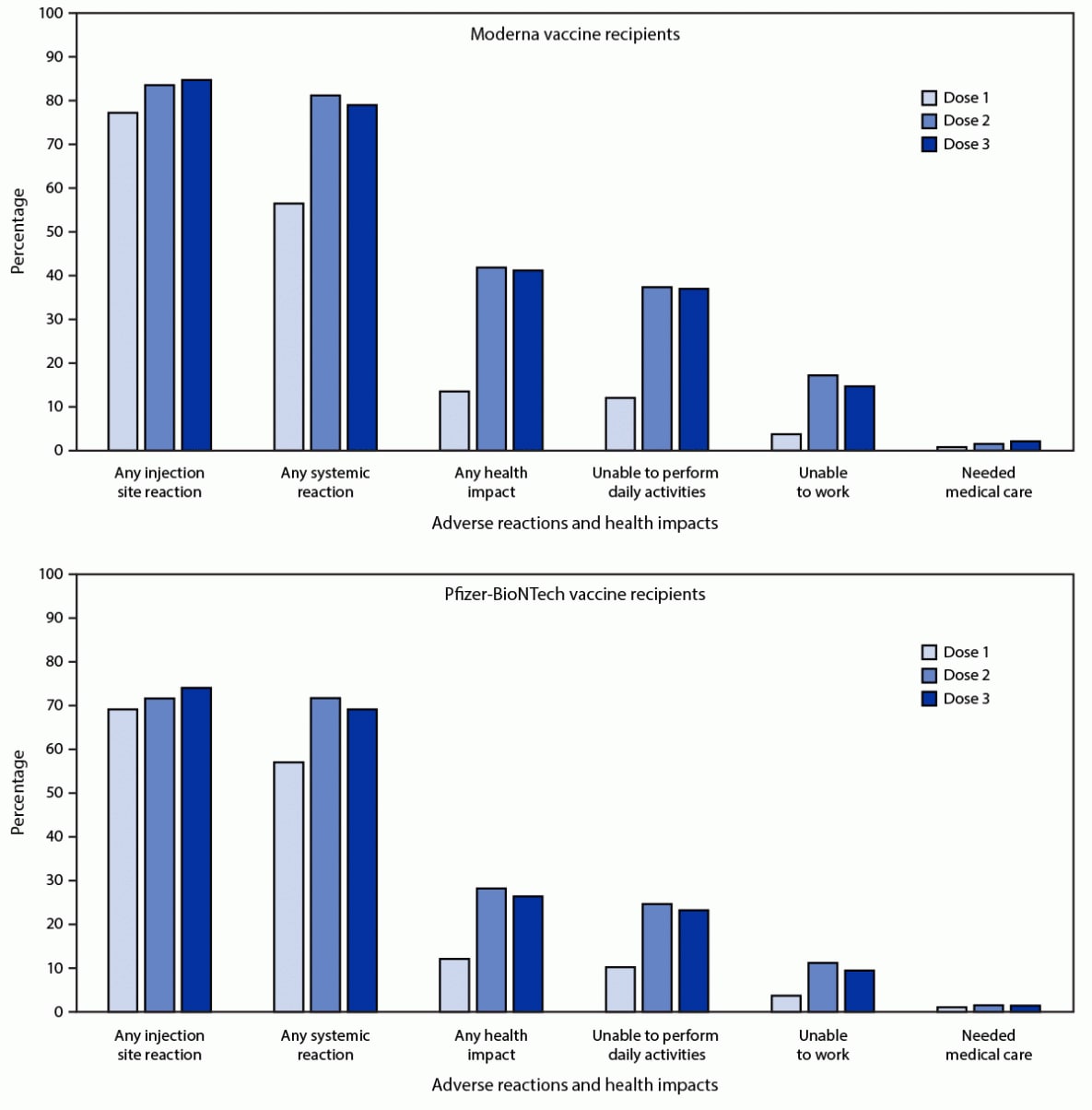
Среди 21,658 3 v-safe зарегистрированных лиц, которые получили одну и ту же мРНК вакцину для всех 12,591 доз, 58.1 0 (7%) прошли по крайней мере один медицинский осмотр в дни 3–79.4 после всех 74.1 доз; 3% и 77.6% сообщили о местных или системных реакциях, соответственно, после дозы 76.5, по сравнению с 2% и 3%, которые сообщили о местных или системных реакциях, соответственно, после дозы 6,283. Среди зарегистрировавшихся, которые получили 3 дозы Moderna (2 5,323), местное о реакциях сообщалось чаще после дозы 84.7, чем после дозы 5,249 (83.5; 0.03% и XNUMX; XNUMX%; значение p = XNUMX) (фигура). О системных реакциях сообщалось реже после дозы 3, чем после дозы 2 (4,963; 79.0% и 5,105; 81.3%; значение p <0.001).
Среди зарегистрированных лиц, получивших 3 дозы Pfizer-BioNTech (6,308 3), местные реакции наблюдались чаще после дозы 2, чем после дозы 4,674 (74.1; 4,523% и 71.7; 0.001%; значение p <3). Системные реакции регистрировались реже после дозы 2, чем после дозы 4,363 (69.2; 4,524% и 71.7; 0.001%; значение p <3). Среди тех, кто сообщил о боли после введения дозы 4,909 мРНК-вакцины, большинство реакций были легкими (51.4; 4,000%) или умеренными (41.9; 637%); О сильной боли (определяемой как боль, которая затрудняет или делает невозможной повседневную деятельность) сообщили 6.7 (XNUMX%).
Обсуждение
По состоянию на 19 сентября 2021 года примерно 2.21 миллиона человек в США получили дополнительные дозы вакцины против COVID-19.†† после завершения первичной серии. С 12 августа по 19 сентября 2021 г. у 22,191 19 зарегистрировавшегося v-safe, получившего дополнительную дозу вакцины COVID-XNUMX, не наблюдалось никаких неожиданных побочных реакций. Большинство зарегистрированных местных и системных реакций были легкими или умеренными, преходящими и чаще всего сообщались на следующий день после вакцинации. Большинство зарегистрированных лиц, получивших дополнительную дозу, сообщили о серии первичной вакцинации мРНК, за которой следовала третья доза от того же производителя.
Клиническое исследование Pfizer-BioNTech, в котором участвовали 306 человек в возрасте 18–55 лет, показало, что реакции после приема дозы 3 были сопоставимы с реакциями, полученными после приема дозы 2 (3). Однако этот анализ данных v-safe показал, что местные реакции были немного более частыми, а системные реакции менее частыми после приема 3 дозы Pfizer-BioNTech.
Характер побочных реакций, наблюдаемых после введения дозы 3 вакцины Moderna или Pfizer-BioNTech, соответствовал ранее описанным реакциям после приема дозы 2.
Количество зарегистрированных лиц, которые указали, что они получили 2 дозы вакцины Янссен или получили дополнительную дозу от производителя, отличного от дозы в их первичной серии, было небольшим, что ограничивает любые выводы.
Данные о безопасности или эффективности вакцинации вакцинами против COVID-19 от разных производителей ограничены; Консультативный комитет по практике иммунизации (ACIP) рекомендует, чтобы люди с умеренно или сильно ослабленным иммунитетом получали третью дозу мРНК вакцины COVID-19 от того же производителя, что и их первичная серия.
Рекомендации CDC по дополнительной дозе в настоящее время не включают людей, получивших вакцину Янссена.
В течение периода, охватываемого этим исследованием, рекомендации ACIP по дополнительной дозе вакцины COVID-19 были ограничены лицами с умеренно или сильно ослабленным иммунитетом, которые получили
2 дозы вакцины мРНК.
Исследование, проведенное среди пациентов с ослабленным иммунитетом на гемодиализе, показало, что местные и системные реакции после дозы 3 вакцины Pfizer-BioNTech были аналогичны таковым после дозы 2.¶¶ Недавние сообщения об инфекциях среди вакцинированных лиц и рост распространенности инфекции B.1.617.2 (Delta) варианта SARS-CoV-2, вируса, вызывающего COVID-19, среди вакцинированных лиц могли побудить некоторых людей искать дополнительная доза вне рекомендаций. Средний интервал от завершения первичной серии до получения дополнительной дозы составил примерно 6 месяцев; таким образом, лица, которым было отдано предпочтение во время развертывания вакцин против COVID-19, в том числе медицинские работники и пожилые люди, могли получить дополнительную дозу.
Выводы в этом отчете подвержены как минимум четырем ограничениям. Во-первых, включение в программу v-safe является добровольным и, вероятно, не репрезентативно для вакцинированного населения США; большинство участников назвали себя белыми и неиспаноязычными. Во-вторых, в течение этого периода исследования рекомендации по дополнительным дозам были ограничены людьми с иммунодефицитными состояниями, которые прошли серию первичной вакцинации против мРНК COVID-19; однако v-safe не включает информацию об иммунном статусе.
Реципиенты дополнительных доз, вероятно, включают людей с иммунодефицитными состояниями и без них. В-третьих, причинно-следственная связь между вакциной и клинически серьезным нежелательным явлением, зарегистрированным после вакцинации, не может быть установлена с использованием данных v-safe. Наконец, было недостаточно данных для определения характера побочных реакций после получения дополнительной дозы от производителя, отличной от первичной серии, или для вакцины Янссен.
Дополнительная доза вакцины мРНК COVID-19 рекомендуется для людей с умеренно или сильно ослабленным иммунитетом (5).
CDC рекомендовал дополнительную дозу вакцины Pfizer-BioNTech через ≥6 месяцев после завершения серии первичной вакцинации среди лиц в возрасте ≥65 лет, лиц, проживающих в учреждениях длительного ухода, и лиц в возрасте 50–64 лет с сопутствующими заболеваниями; лица в возрасте 18–49 лет с сопутствующими заболеваниями и лица в возрасте 18–64 лет с повышенным риском заражения и передачи COVID-19 из-за профессиональных или институциональных условий могут получить дополнительную дозу в зависимости от их индивидуальных преимуществ и рисков.
Первоначальный анализ данных безопасности от> 22,000 зарегистрированных лиц с v-safe показывает, что местные реакции немного увеличиваются, а системные реакции немного уменьшаются после дозы 3 мРНК, чем после дозы 2.
Не было выявлено никаких неожиданных паттернов побочных реакций; те, о которых сообщалось, были от легкой до умеренной и преходящей. CDC продолжит следить за безопасностью дополнительных доз вакцины COVID-19. Дополнительные данные о побочных реакциях, связанных с различными комбинациями вакцин, и о времени, прошедшем после завершения первичной серии, будут важны для выработки рекомендаций общественного здравоохранения.
| Характеристика | Модерна,%† (n = 10,601 XNUMX) | Pfizer-BioNTech,%† (n = 11,412 XNUMX) | Янссен,%†, § (n = 178 XNUMX) | Всего (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Доза 3 Модерна (n = 10,453 98.6; XNUMX%) | Доза 3 Pfizer-BioNTech (n = 144 1.4; XNUMX%) | Доза 3 Янссен (n = 4 0.04; XNUMX%) | Доза 3 Pfizer-BioNTech (n = 11,209 98.2; XNUMX%) | Доза 3 Модерна (n = 197 1.7; XNUMX%) | Доза 3 Янссен (n = 6 0.1; XNUMX%) | Доза 2 Янссен (n = 48 27.0; XNUMX%) | Доза 2 Модерна (n = 64 36.0; XNUMX%) | Доза 2 Pfizer-BioNTech (n = 66 37.1; XNUMX%) | ||
| Секс | ||||||||||
| F | 63.8 | 63.9 | 50.0 | 63.0 | 63.5 | 33.3 | 39.6 | 57.8 | 59.1 | 63.3 |
| M | 35.1 | 34.0 | 50.0 | 36.1 | 36.0 | 66.7 | 60.4 | 42.2 | 40.9 | 35.7 |
| неизвестный | 1.0 | 2.1 | 0 | 0.9 | 0.5 | 0 | 0 | 0 | 0 | 1.0 |
| Возрастная группа, лет | ||||||||||
| 0-17 | 0.0 | 0.7 | 0.0 | 0.6 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.3 |
| 18-49 | 25.7 | 36.1 | 25.0 | 31.5 | 42.6 | 50.0 | 54.2 | 60.9 | 57.6 | 29.1 |
| 50-64 | 28.4 | 27.1 | 50.0 | 31.1 | 29.9 | 0.0 | 33.3 | 34.3 | 30.3 | 29.8 |
| 65-74 | 33.9 | 27.1 | 0.0 | 27.8 | 21.3 | 50.0 | 10.4 | 4.7 | 9.1 | 30.5 |
| 75-84 | 10.9 | 9.0 | 25.0 | 8.3 | 5.6 | 0.0 | 2.1 | 0.0 | 3.0 | 9.5 |
| ≥85 | 1.1 | 0.0 | 0.0 | 0.7 | 0.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.9 |
| национальность | ||||||||||
| Испанец / выходец из Латинской Америки | 8.0 | 15.3 | 0 | 8.2 | 5.6 | 0 | 25.0 | 6.3 | 10.6 | 8.2 |
| Неиспаноязычные / латиноамериканцы | 87.7 | 81.9 | 100 | 87.6 | 90.9 | 100 | 54.2 | 89.1 | 89.4 | 87.6 |
| неизвестный | 4.3 | 2.8 | 0 | 4.2 | 3.6 | 0 | 20.8 | 4.7 | 0 | 4.2 |
| Гонки | ||||||||||
| AI / AN | 0.5 | 0.7 | 0 | 0.5 | 0.5 | 0 | 2.1 | 0 | 0 | 0.5 |
| Азиатская кухня | 4.9 | 5.6 | 0 | 6.1 | 7.1 | 0 | 2.1 | 14.1 | 13.6 | 5.6 |
| Черный | 5.6 | 3.5 | 0 | 6.2 | 1.5 | 16.7 | 6.3 | 6.3 | 9.1 | 5.9 |
| НГПИ | 0.2 | 0 | 0 | 0.3 | 0.5 | 0 | 4.2 | 0 | 0 | 0.3 |
| Белый | 82.6 | 82.6 | 100 | 80.4 | 85.8 | 66.7 | 56.3 | 71.9 | 69.7 | 81.4 |
| многорасовый | 1.9 | 2.1 | 0 | 1.8 | 1.5 | 16.7 | 4.2 | 4.7 | 3.0 | 1.9 |
| Другое | 2.1 | 4.2 | 0 | 2.1 | 0.5 | 0 | 6.3 | 1.6 | 3.0 | 2.1 |
| неизвестный | 2.3 | 1.4 | 0 | 2.5 | 2.5 | 0 | 18.8 | 1.6 | 1.5 | 2.4 |
Сокращения: AI / AN = американские индейцы / коренные жители Аляски; NHPI = коренной житель Гавайев или других островов Тихого океана.
* Процент зарегистрировавшихся, которые прошли по крайней мере один опрос v-safe медосмотра в дни 0–7 после вакцинации.
† Серия первичной вакцинации.
§ Включает лиц, получивших первичную однократную дозу вакцины Янссен и 1 дополнительную дозу вакцины от перечисленных производителей.
| реакция | Модерна,%† (n = 10,477 XNUMX) | Pfizer-BioNTech,%† (n = 11,284 XNUMX) | Янссен,%†, § (n = 174 XNUMX) | Всего (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Доза 3 Модерна (n = 10,453 98.6; XNUMX%) | Доза 3 Pfizer-BioNTech (n = 144 1.4; XNUMX%) | Доза 3 Янссен (n = 4 0.04; XNUMX%) | Доза 3 Pfizer-BioNTech (n = 11,209 98.2; XNUMX%) | Доза 3 Модерна (n = 197 1.7; XNUMX%) | Доза 3 Янссен (n = 6 0.1; XNUMX%) | Доза 2 Янссен (n = 48 27.0; XNUMX%) | Доза 2 Модерна (n = 64 36.0; XNUMX%) | Доза 2 Pfizer-BioNTech (n = 66 37.1; XNUMX%) | ||
| Количество дней с момента первичной серии, медиана (IQR) | 182 (164-198) | 183 (161-204) | 173 (141-182) | 183 (157-209) | 186 (161-217) | 123 (113-182) | 84 (16-136) | 156 (140-164) | 150 (136-167) | 182 (160-202) |
| Любая реакция в месте инъекции | 80.9 | 64.6 | 75.0 | 69.4 | 81.7 | 83.3 | 25.0 | 70.3 | 80.3 | 74.9 |
| Зудящий | 20.0 | 11.8 | 0 | 8.4 | 10.2 | 16.7 | 10.4 | 6.3 | 7.6 | 13.9 |
| боль | 75.9 | 60.4 | 75.0 | 66.6 | 80.2 | 83.3 | 20.8 | 68.8 | 74.2 | 71.0 |
| краснота | 25.2 | 8.3 | 0 | 9.8 | 20.8 | 16.7 | 6.3 | 7.8 | 12.1 | 17.1 |
| припухлость | 33.6 | 17.4 | 0 | 16.8 | 30.5 | 16.7 | 6.3 | 12.5 | 18.2 | 24.8 |
| Любая системная реакция | 75.2 | 59.7 | 50.0 | 65.1 | 76.1 | 100 | 31.3 | 68.8 | 63.6 | 69.9 |
| Боль в животе | 8.4 | 3.5 | 0 | 6.4 | 8.1 | 16.7 | 4.2 | 3.1 | 6.1 | 7.3 |
| миальгия | 49.8 | 29.2 | 0 | 36.3 | 49.2 | 50.0 | 20.8 | 45.3 | 33.3 | 42.7 |
| Озноб | 31.3 | 8.3 | 50.0 | 17.5 | 33.5 | 50.0 | 8.3 | 23.4 | 10.6 | 24.1 |
| Расстройство желудка | 9.9 | 7.6 | 0 | 9.0 | 9.6 | 16.7 | 8.3 | 6.3 | 9.1 | 9.4 |
| Усталость | 61.8 | 44.4 | 0 | 51.0 | 60.9 | 83.3 | 14.6 | 48.4 | 50.0 | 56.0 |
| Лихорадка | 36.4 | 20.1 | 50.0 | 22.2 | 37.1 | 50.0 | 6.3 | 37.5 | 12.1 | 29.0 |
| Головная боль | 49.0 | 31.1 | 0 | 38.4 | 49.7 | 83.3 | 18.8 | 35.9 | 40.9 | 43.4 |
| боль в суставах | 33.0 | 18.8 | 0 | 23.0 | 31.0 | 33.3 | 16.7 | 20.3 | 19.7 | 27.7 |
| Тошнота | 18.8 | 10.4 | 25.0 | 13.6 | 21.3 | 33.3 | 8.3 | 9.4 | 18.2 | 16.1 |
| Сыпь | 2.3 | 0.7 | 0 | 1.9 | 2.5 | 0 | 4.2 | 1.6 | 1.5 | 2.1 |
| Рвота | 2.2 | 2.1 | 25.0 | 1.4 | 2.0 | 0 | 2.1 | 0 | 0 | 1.7 |
| Любое воздействие на здоровье | 39.2 | 19.4 | 0 | 25.2 | 39.1 | 33.3 | 16.7 | 28.1 | 24.2 | 31.8 |
| Невозможно выполнять обычные повседневные дела | 35.2 | 18.1 | 0 | 22.1 | 33.0 | 33.3 | 10.4 | 25.0 | 15.2 | 28.3 |
| Невозможно работать или посещать школу | 13.7 | 4.9 | 0 | 9.0 | 21.3 | 16.7 | 10.4 | 6.3 | 13.6 | 11.3 |
| Требуется медицинская помощь | 2.1 | 1.4 | 0 | 1.5 | 3.0 | 0 | 6.3 | 0 | 0 | 1.8 |
| Телездравоохранение | 0.9 | 0.7 | 0 | 0.7 | 1.0 | 0 | 2.1 | 0 | 0 | 0.8 |
| клиника | 0.7 | 0.7 | 0 | 0.6 | 0.5 | 0 | 4.2 | 0 | 0 | 0.6 |
| Экстренный визит | 0.2 | 0 | 0 | 0.2 | 0 | 0 | 4.2 | 0 | 0 | 0.2 |
| госпитализация | 0.05 | 0 | 0 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0.1 |
РИСУНОК. О побочных реакциях и воздействии на здоровье сообщили лица, получившие 3 дозы * вакцины Moderna (N = 6,283 6,308) или Pfizer-BioNTech (N = 19 0) COVID-7 и выполнившие по крайней мере один v-safe контрольный опрос здоровья в дни 12–19. 2021 после каждой дозы, по номеру дозы - США, XNUMX августа - XNUMX сентября XNUMX г.
ЧТО ВЫНУТЬ ИЗ ЭТОЙ СТАТЬИ:
- Результаты клинического исследования фазы 3, проведенного компанией Pfizer-BioNTech с участием 306 человек в возрасте 18–55 лет, показали, что побочные реакции после получения третьей дозы, введенной через 5–8 месяцев после завершения серии первичной вакцинации мРНК из 2 доз, были аналогичны таковым. те, о которых сообщалось после получения дозы 2.
- Лица, которые сообщили о получении первичной серии вакцины от разных производителей или производителя, который был неизвестен или недоступен в США, или 2 доз вакцины после получения вакцины Janssen (Johnson &.
- 12 августа 2021 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) внесло поправки в разрешения на экстренное использование (EUA) вакцин Pfizer-BioNTech и Moderna против COVID-19, разрешив введение дополнительной дозы после завершения серии первичной вакцинации лицам, имеющим на это право с иммунодефицитные состояния от умеренной до тяжелой степени (1,2).























